2×TaqPCRミックス
アクティビティの定義
1ユニット(U)のTaq DNAポリメラーゼの活性は、活性化されたサケ精子DNAをテンプレート/プライマーとして使用し、74℃で30分以内に10nmolのデオキシヌクレオチドを酸不溶性物質に組み込むために必要な酵素の量として定義されます。
品質管理
SDS-PAGE検出による純度は99%以上です。外因性ヌクレアーゼの活性は検出されません。ヒトゲノムのシングルコピー遺伝子は効果的に増幅することができます。室温で1週間保存しても、有意な活性変化はありません。
主な技術的パラメータ
この酵素は、5'-3 'ポリメラーゼ活性および5'-3'エキソヌクレアーゼ活性を有し、3'-5 'エキソヌクレアーゼ活性を有さない。DNA重合の伸長速度は、70〜75℃で1〜2kb /分です。PCR産物には3'-dAオーバーハングがあり、TAクローニングベクターに直接クローニングできます。
アプリケーション
これは一般に、増幅、プライマー伸長、シーケンシング、および6 kb未満で忠実度の要件が低いDNAの平滑末端でのAテーリングに使用されます。
すべての製品はODM / OEM用にカスタマイズできます。詳細については、カスタマイズされたサービス(ODM / OEM)をクリックしてください
 |
1kbフラグメントを増幅するためのテンプレートとしてヒトゲノムDNAを使用 |
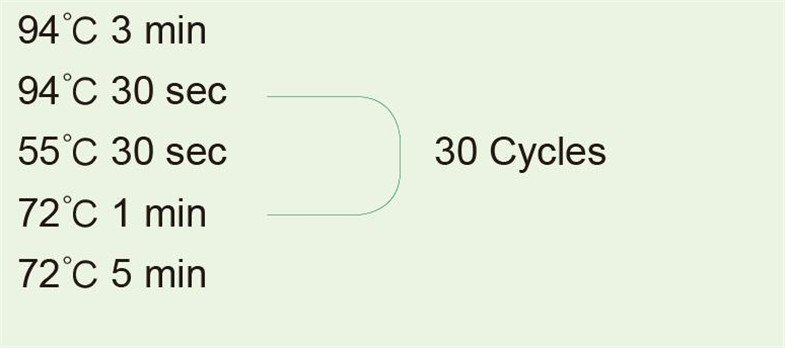 |
PCR反応後、電気泳動検出用に5μlを取ります。 |
A-1テンプレート
■テンプレートには、タンパク質不純物やTaq阻害剤などが含まれています。—— DNAテンプレートを精製するか、タンパク質不純物を除去するか、精製キットを使用してテンプレートDNAを抽出します。
■テンプレートの変性が完了していません-変性温度を適切に上げ、変性時間を延長します。
■テンプレートの劣化-テンプレートを再準備します。
A-2プライマー
■プライマーの品質が悪い-プライマーを再合成します。
■プライマーの分解-高濃度のプライマーを少量に分注して保存します。複数回の凍結融解や4°Cでの長期凍結保存は避けてください。
■プライマーの不適切な設計(例:プライマーの長さが不十分、プライマー間に二量体が形成されているなど)-プライマーを再設計します(プライマーの二量体と二次構造の形成を避けます)
A-3Mg2+集中
■Mg2+ 濃度が低すぎる-Mgを適切に増やす2+ 濃度:Mgを最適化する2+ 最適なMgを決定するための0.5mMの間隔での1mMから3mMまでの一連の反応による濃度2+ 各テンプレートとプライマーの濃度。
A-4アニーリング温度
■高いアニーリング温度は、プライマーとテンプレートの結合に影響を与えます。-アニーリング温度を下げ、2°Cの勾配で条件を最適化します。
A-5延長時間
■短い延長時間-延長時間を増やします。
現象:ネガティブサンプルは、ターゲットシーケンスバンドも示します。
A-1PCRの汚染
■ターゲットシーケンスまたは増幅産物の相互汚染-ネガティブサンプルにターゲットシーケンスを含むサンプルをピペッティングしたり、遠心分離管からこぼしたりしないように注意してください。試薬または機器は、既存の核酸を除去するためにオートクレーブ処理する必要があり、汚染の存在は、ネガティブコントロール実験を通じて決定する必要があります。
■試薬のコンタミネーション-試薬を分注し、低温で保管します。
A-2プライムr
■Mg2+ 濃度が低すぎる-Mgを適切に増やす2+ 濃度:Mgを最適化する2+ 最適なMgを決定するための0.5mMの間隔での1mMから3mMまでの一連の反応による濃度2+ 各テンプレートとプライマーの濃度。
■プライマーの設計が不適切であり、標的配列が非標的配列と相同性を持っている。-プライマーを再設計します。
現象:PCR増幅バンドは、予想されるサイズと一致していません。大きいか小さいか、または特定の増幅バンドと非特定の増幅バンドの両方が発生することがあります。
A-1プライマー
■プライマーの特異性が低い
-プライマーを再設計します。
■プライマー濃度が高すぎる-変性温度を適切に上げ、変性時間を長くします。
A-2 Mg2+ 集中
■Mg2+ 濃度が高すぎる-Mg2 +濃度を適切に下げる:Mgを最適化する2+ 最適なMgを決定するための0.5mMの間隔での1mMから3mMまでの一連の反応による濃度2+ 各テンプレートとプライマーの濃度。
A-3耐熱性ポリメラーゼ
■酵素量が多すぎる-0.5U間隔で酵素量を適切に減らしてください。
A-4アニーリング温度
■アニーリング温度が低すぎる-アニーリング温度を適切に上げるか、2段階アニーリング法を採用してください
A-5PCRサイクル
■PCRサイクルが多すぎます-PCRサイクルの数を減らします。
A-1プライマー-特異性が低い-プライマーを再設計し、プライマーの位置と長さを変更して特異性を高めます。またはネストされたPCRを実行します。
A-2テンプレートDNA
-テンプレートは純粋ではありません-テンプレートを精製するか、精製キットを使用してDNAを抽出します。
A-3Mg2+ 集中
-mg2+ 濃度が高すぎる-Mgを適切に減らす2+ 濃度:Mgを最適化する2+ 最適なMgを決定するための0.5mMの間隔での1mMから3mMまでの一連の反応による濃度2+ 各テンプレートとプライマーの濃度。
A-4 dNTP
-dNTPの濃度が高すぎる-dNTPの濃度を適切に下げる
A-5アニーリング温度
-アニーリング温度が低すぎる-アニーリング温度を適切に上げる
A-6サイクル
-サイクル数が多すぎます-サイクル数を最適化してください

最初のステップは、適切なポリメラーゼを選択することです。通常のTaqポリメラーゼは、3'-5 'エキソヌクレアーゼ活性がないため校正できず、ミスマッチはフラグメントの伸長効率を大幅に低下させます。したがって、通常のTaqポリメラーゼは、5kbを超えるターゲットフラグメントを効果的に増幅することはできません。伸長効率を改善し、長いフラグメント増幅のニーズを満たすために、特別な修飾を施したTaqポリメラーゼまたは他の忠実度の高いポリメラーゼを選択する必要があります。さらに、長いフラグメントの増幅には、プライマーデザイン、変性時間、伸長時間、バッファーpHなどの対応する調整も必要です。通常、18〜24bpのプライマーはより良い収量をもたらす可能性があります。テンプレートの損傷を防ぐために、94°Cでの変性時間は1サイクルあたり30秒以下に短縮し、増幅前に温度を94°Cに上昇させる時間は1分未満にする必要があります。さらに、伸長温度を約68℃に設定し、1kb /分の速度で伸長時間を設計することにより、長い断片の効果的な増幅を確実にすることができます。
PCR増幅のエラー率は、忠実度の高いさまざまなDNAポリメラーゼを使用することで減らすことができます。これまでに見つかったすべてのTaqDNAポリメラーゼの中で、Pfu酵素はエラー率が最も低く、忠実度が最も高くなっています(添付の表を参照)。酵素の選択に加えて、研究者は、バッファー組成の最適化、耐熱性ポリメラーゼの濃度、PCRサイクル数の最適化など、反応条件を最適化することにより、PCR変異率をさらに減らすことができます。
製品カテゴリ
私たちを選ぶ理由
当工場は創業以来、原則を守りながら世界一流の製品を開発してきました。
最初に品質の。当社の製品は、業界で高い評価を得ており、新旧のお客様の間で貴重な信頼を得ています。








