FastKing gDNA Dispelling RT SuperMix
特徴
■高速:テンプレートを追加するだけで、18分以内にゲノム除去と効率的な逆転写を完了するためのワンステップ。
■高効率:逆転写酵素は疎水性モチーフで修飾されており、RT効率は95%を超えています。
■シンプルで簡単:独自の感熱性DNaseは、効果が速く、効率が高く、反応時間が短く、cDNAに影響を与えません。
仕様
タイプ: 遺伝子改変逆転写酵素、gDNase
手順: ワンステップ(ゲノムDNA除去およびRT)
RT効率: > 95%
レンプレート: 1ng-2μg
稼働時間: 〜18分
アプリケーション: 逆転写されたcDNAは、従来のPCR、リアルタイムPCR、cDNAライブラリーの構築、SAGE(遺伝子発現のシリアル分析)、プライマー伸長、およびその他の従来の実験で使用できます。
すべての製品はODM / OEM用にカスタマイズできます。詳細については、カスタマイズされたサービス(ODM / OEM)をクリックしてください
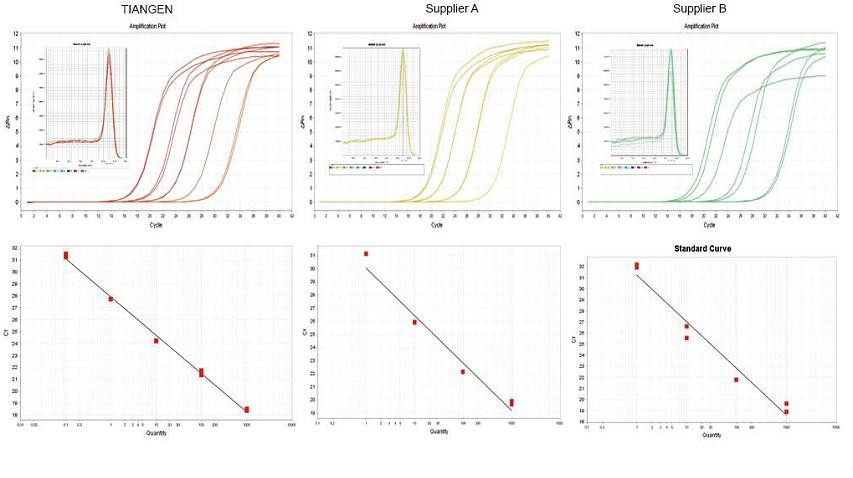 |
実験例1.cDNAは、TIANGEN FastKing gDNA Dispelling RT SuperMixのワンステップ逆定量試薬、それぞれサプライヤーAおよびサプライヤーBの関連製品を使用して合成されました。TIANGEN Talent qPCR PreMix(SYBR Green)を使用してマウスのRN5遺伝子を検出し、増幅曲線、融解曲線、検量線を分析しました。結果は、TIANGEN FastKing gDNA Dispelling RT SuperMixが逆転写後の最高の定量的Ct値と優れたストレス耐性を持ち、不純物残基の多いテンプレートに明らかな利点があることを示しています。 |
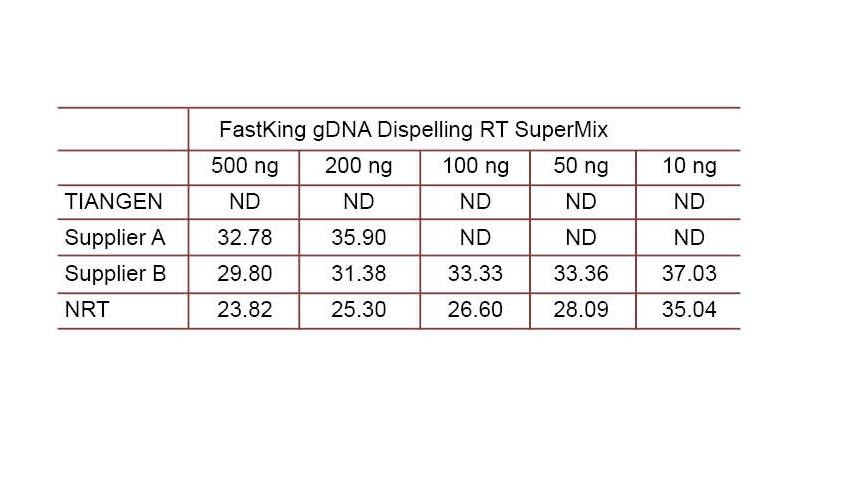 |
実験例2.cDNAは、TIANGEN FastKing gDNA Dispelling RT SuperMixのワンステップ逆定量試薬、それぞれサプライヤーAおよびサプライヤーBの関連製品を使用して合成されました。TIANGEN Talent qPCR PreMix(SYBR Green)を使用してヒトHsG遺伝子を検出し、さまざまな濃度のゲノムDNAを手動で追加して、さまざまな試薬のgDNA除去能力を検出します。Ctの結果は、TIANGEN FastKing gDNA Dispelling RTSuperMixがゲノムDNAを除去する優れた能力を持っていることを示しています。結果に影響を与えることなく、最大500ngのゲノムDNA残基を完全に除去できます。ND:検出されません。NRT:逆転写なしのミックスの検出。 |
A-1RNAが分解される
-コンタミネーションのない高品質のRNAを精製します。RNAの分解を防ぐために、RNAを抽出する材料はできるだけ新鮮でなければなりません。RT反応の前に変性ゲル上のRNAの完全性を分析します。RNA抽出後、100%ホルムアミドで保存する必要があります。RNase阻害剤を使用する場合、加熱温度は45°C未満、pHは8.0未満にする必要があります。そうしないと、阻害剤が結合したすべてのRNaseを放出します。さらに、RNase阻害剤は0.8 mMDTT以上を含む溶液に添加する必要があります。
A-2RNAには逆転写反応の阻害剤が含まれています
-逆転写阻害剤には、SDS、EDTA、グリセロール、ピロリン酸ナトリウム、スペルミジン、ホルムアミド、グアニジン塩などがあります。コントロールRNAをサンプルと混合し、収量をコントロールRNA反応と比較して、阻害剤があるかどうかを確認します。RNA沈殿物を70%(v / v)エタノールで洗浄して阻害剤を除去します。
A-3cDNAの最初の鎖を合成するために使用されるプライマーの不十分なアニーリング
-アニーリング温度が実験で使用されるプライマーに適していることを確認します。ランダムヘキサマーの場合、反応温度に達する前に、温度を25°Cで10分間維持することをお勧めします。遺伝子特異的プライマー(GSP)については、他のGSPを試すか、オリゴ(dT)またはランダムヘキサマーに切り替えてください。
A-4少量の開始RNA
-RNAの量を増やします。50 ng未満のRNAサンプルの場合、0.1μgから0.5μgのアセチルBSAを第1鎖cDNA合成に使用できます。
A-5分析した組織では標的配列が発現していません。
-他の組織を試してください。
A-6PCR反応が失敗する
-2ステップRT-PCRの場合、PCRステップのcDNAテンプレートは反応量の1/5を超えることはできません。
A-1プライマーとテンプレートの非特異的アニーリング
-プライマーの3 '末端に2〜3dGまたはdCを含めないでください。ランダムプライマーまたはオリゴ(dT)の代わりに、第1鎖合成で遺伝子特異的プライマーを使用します。最初の数サイクルではより高いアニーリング温度を使用し、次により低いアニーリング温度を使用します。PCRにホットスタートTaqDNAポリメラーゼを使用して、反応の特異性を向上させます。
A-2遺伝子特異的プライマーの設計が不十分
-増幅プライマーの設計についても同じ原則に従います。
A-3ゲノムDNAで汚染されたRNA
-PCRグレードのDNaseIでRNAを処理します。DNAコンタミネーションを検出するために、逆転写を行わずにコントロール反応をセットアップします。
A-4プライマーダイマーの形成
-3 '末端に相補配列のないプライマーを設計します。
A-5Mgが高すぎる2+ 集中
-Mgを最適化する2+ 各テンプレートとプライマーの組み合わせの濃度
A-6外来DNAで汚染されている
-エアロゾル耐性のあるチップとUDG酵素を使用します。
A-1ファーストストランド製品の含有量が多すぎます
-従来のPCR反応ステップでファーストストランド産物の量を減らします。
A-2PCR反応におけるプライマー量が多すぎる
-プライマーの入力を減らします。
A-3サイクルが多すぎます
-PCR反応条件を最適化し、PCRサイクル数を減らします。
A-4アニーリング温度が低すぎる
-アニーリング温度を上げて、非特異的な開始と伸長を防ぎます。
A-5DNAのDNase分解によって生成されたオリゴヌクレオチドフラグメントの非特異的増幅-高品質のRNAを抽出してDNAのコンタミネーションを防ぎます。
RT-PCRは、RNAをcDNAに逆転写し、逆転写されたcDNAをPCR反応のテンプレートとして使用してターゲットフラグメントを増幅します。実験の特定の条件に応じて、ランダムプライマー、オリゴdT、および遺伝子特異的プライマーのいずれかを選択します。上記のすべてのプライマーは、ヘアピン構造のない短い真核細胞のmRNAに使用できます。
ランダムプライマー:ヘアピン構造のロングRNAだけでなく、rRNA、mRNA、tRNAなどのあらゆる種類のRNAに適しています。主に単一テンプレートのRT-PCR反応に使用されます。
Oligo dT:PolyAテーリングのあるRNAに適しています(原核生物のRNA、真核生物のOligo dT rRNAおよびtRNAにはPolyAテールがありません)。オリゴdTはPolyAテールに結合しているため、RNAサンプルの品質を高くする必要があり、少量の分解でも完全長cDNA合成の量が大幅に減少します。
遺伝子特異的プライマー:テンプレート配列を補完し、標的配列がわかっている状況に適しています。
2つの方法があります:
1.内部参照法:理論的には、cDNAは異なる長さのDNAフラグメントであるため、電気泳動の結果は不鮮明です。RNAの存在量が少ない場合、電気泳動に生成物は表示されませんが、これはPCRによって生成物が増幅されないことを意味するものではありません。一般に、内部参照はcDNAを検出するために使用できます。内部参照に結果があれば、基本的にcDNAの品質を保証することができます(場合によっては、標的遺伝子の断片が長すぎると例外が生じることがあります)。
2.このテンプレートで増幅された既知の遺伝子がある場合は、この遺伝子のプライマーで確認できます。内部参照の増幅は、必ずしもcDNAに問題がないことを意味するわけではありません。内部参照はcDNAが豊富であるため、増幅が容易です。さまざまな理由でcDNAが部分的に分解されると、確率の観点から、存在量の少ない標的遺伝子のPCR結果に大きな影響を与えます。内部リファレンスはまだ豊富にありますが、増幅はおそらく影響を受けません。
RNAの部分的な分解。RNAの完全性を検出して精製する
異なる種のRNA含有量は異なる場合がありますが、一般に、抽出されたトータルRNAには、ゲル電気泳動で2つの明確な28Sおよび18Sバンドが含まれ、前者のバンドの輝度は後者の2倍である必要があります。5Sバンドは、RNAが分解されたことを示し、その明るさは分解の程度に比例します。内部リファレンスの増幅が成功したからといって、RNAに問題がないわけではありません。内部リファレンスが豊富にあるため、分解がひどくない限り、RNAを増幅することができます。OD260/ OD280分光光度計で測定した純粋なRNAの比率は1.9から2.1の間でなければなりません。RNA中の少量のタンパク質不純物は比率を低下させます。値が低すぎない限り、RTは影響を受けません。RTにとって最も重要なのはRNAの完全性です。
内部参照遺伝子の伸長は、RTが成功したことを示すだけであり、cDNA鎖の品質に必ずしも関係しているわけではありません。内部参照フラグメントは一般にサイズが小さく、発現が高いため、逆転写に成功するのは簡単です。ただし、標的遺伝子のサイズと発現は遺伝子ごとに異なります。特に2kbより長い標的フラグメントについては、cDNAの品質を内部参照だけで判断することはできません。
一部のサンプルは、複雑な二次構造を持っているか、GC含量が豊富であるか、または存在量が少なく貴重です。このような場合、ターゲットフラグメントとサンプルのサイズに応じて適切な逆転写酵素を選択する必要があります。GC含量が高く複雑な二次構造を持つRNAテンプレートの場合、低温で、または一般的な逆転写酵素で二次構造を開くことは困難です。これらのテンプレートでは、Quant Reverse Transcriptaseを選択できます。これは、さまざまなRNAテンプレートを効率的に逆転写し、RNAをcDNAの第1鎖に最大限に転写できるM-MLVシリーズ逆転写酵素よりも逆転写性能が明らかに優れているためです。一般的な逆転写酵素キットを使用する場合、20μlのシステムは1μgのトータルRNAのみを効果的に逆転写することができます。キットの最大RT容量に注意してください。テンプレートを過剰に添加すると、逆転写により豊富なRNAが優先されます。したがって、システムの最大容量を超えないようにすることをお勧めします。
A-1 RNAがひどく分解されているかどうか、RTが成功したかどうかを確認します
一般に、内部リファレンス増幅が失敗する理由は、多くの場合、深刻なRNA分解によって引き起こされます。もう1つの考えられる理由は、逆転写の失敗です。内部リファレンスは、cDNA一本鎖の品質を判断するための基準として使用することはできませんが、RNAの品質に問題がなければ逆転写が成功するかどうかを判断するための基準として使用できます。逆転写プロセスで最も重要なことは、反応効率を向上させるために、一定の温度と一定の反応システムを維持することです。
A-2内部参照遺伝子を増幅するためのプライマーが信頼できるかどうか、およびPCRで使用される試薬に問題があるかどうかを判断します。
相対的な定量化では、逆転写の前にRNAを定量化する必要があります。これは、多くの逆転写キットでも必要です。たとえば、RNA入力を1μgとして定量化します。逆転写cDNAはRNA、オリゴdT、酵素、dNTP、DNA残基が少しでも混ざった溶液であるため、ずれが生じ、cDNAを正確に定量することができません。したがって、RNAの定量化が必要です。逆転写効率が異なるサンプル間で同じであることを考慮すると、得られるcDNAの量は同じである必要があり、定量分析は、同じ量のトータルRNAにおける異なる遺伝子の発現レベルの比較を示すことができます。相対蛍光定量PCRを行う場合、内部参照遺伝子が参照として機能するため、逆転写後に定量cDNAが必要ない場合があります。
これは主に遺伝子に関連しており、長いフラグメントの逆転写はほとんどの遺伝子で実行可能ではありません。第一に、逆転写の効率はPCRの効率よりはるかに低い。第二に、GCリッチ領域と多くの遺伝子の二次構造が逆転写とPCRの両方を制限します。最後に、PCRの忠実度と増幅効率を同時に保証することは困難です。逆転写の過程で、特にオリゴdTを使用して、低コピー遺伝子の長いフラグメントを取得することを保証することはできません。より多くのGCを備えた5'UTRに関しては、それはさらに困難です。したがって、ランダムプライマーを使用して転写物を逆転写し、ターゲットフラグメント内の自然な切断部位を見つけ、セグメントごとに増幅してから、制限消化とライゲーションを実行することは、依然として合理的な方法です。一般に、2 kbを超えるフラグメントを直接増幅することは困難ですが、常に取得できるとは限りません。1。まず、RNA / mRNAの完全性を保証し、TRIZOL抽出をお勧めします。2.M-MLVRT-PCRキットを直接使用できます。アニーリング時間を延長し、増幅プロセスのサイクル数を適切に増やします。あるいは、ネストされたPCRを適用するか、通常のPCR増幅の前に適切に延長された変性と延長時間で最初に1つまたは2つの反応を実行することができます。これは、フラグメントの延長に役立つ場合があります。ポリメラーゼの忠実度に注意してください。3.Long TaqをPCRで使用して、理想的な結果を得ることができます。4.タンパク質発現アプリケーションには、忠実度の高いポリメラーゼを適用する必要があります。
TIANGENが提供する逆転写酵素には、Quant / KingRTaseとTIANScriptM-MLVの2種類があります。それらの主な違いは、テンプレートの入力量です。Quantはユニークな逆転写酵素であり、モロニーマウス白血病ウイルスに由来する一般的に使用されているM-MLVとは異なります。Quantは、Escherichiacoliのエンジニアリングによって組換え発現された新しい高効率逆転写酵素です。Quantは、50ng-2μgのRNAを高い逆転写活性と高収率で増幅するのに適しています。通常のMMLVまたはAMVと比較して、Quantの最大の特徴は、RNAテンプレートとの親和性が非常に高く、高温変性なしに転写複合体テンプレートを逆転写できることです。GC含量が高いテンプレートの場合、逆効率は高くなります。ただし、この逆転写酵素にはRNase H活性があり、cDNA産物の長さに影響を与える可能性があります(4.5 kb未満のテンプレートに適しています)。従来の逆転写には、TIANScriptMMLV逆転写酵素が推奨されます。このRTaseは、RNase H活性が非常に弱い修飾酵素であり、長い(> 5 kb)cDNA合成に適しています。
ワンステップの逆転写とPCR増幅は、cDNA合成と増幅の間にチューブカバーを開かずに同じチューブで完了します。これは、コンタミネーションを減らすのに役立ちます。得られたすべてのcDNAサンプルが増幅に使用されるため、感度が高くなり、最小で0.01pgのトータルRNAが得られます。ワンステップRTPCRを成功させるには、一般に遺伝子特異的プライマーを使用してcDNA合成を開始します。2段階の方法、すなわち逆転写とPCR増幅は2段階で実行されます。まず、RNAテンプレートから逆転写を行ってcDNAを取得し、取得したcDNAを1つまたは複数の異なるPCR反応に供します。2段階の方法では、オリゴ(dT)またはランダムプライマーを使用してcDNAの最初の鎖の合成をガイドし、特定のサンプルからのすべてのmRNA情報を逆転写することができます。
製品カテゴリ
私たちを選ぶ理由
当工場は創業以来、原則を守りながら世界一流の製品を開発してきました。
最初に品質の。当社の製品は、業界で高い評価を得ており、新旧のお客様の間で貴重な信頼を得ています。