TIANSeq rRNA枯渇キット(H / M / R)
特徴
■広いサンプル範囲:高品質(完全)および部分的に分解された(FFPEなど)サンプルでのrRNAの枯渇に適しています。
■rRNAの効率的な除去:ヒト/マウス/ラットのrRNAの95〜99.9%が効果的に除去されます。
■包括的なデータ:不完全なmRNAおよび非コードRNA情報が保持されるため、トランスクリプトームデータがより包括的になります。
■迅速な評価:キットに含まれているプライマーは、rRNAの除去効果を迅速に評価できます。
仕様
タイプ: RNAライブラリー調製前のRNA濃縮
サンプル: トータルRNA
目標: mRNAおよび非コードRNA
開始ボリューム: 100ng-1μg
稼働時間: 2時間
ダウンストリームアプリケーション: RNAライブラリーの準備
すべての製品はODM / OEM用にカスタマイズできます。詳細については、カスタマイズされたサービス(ODM / OEM)をクリックしてください
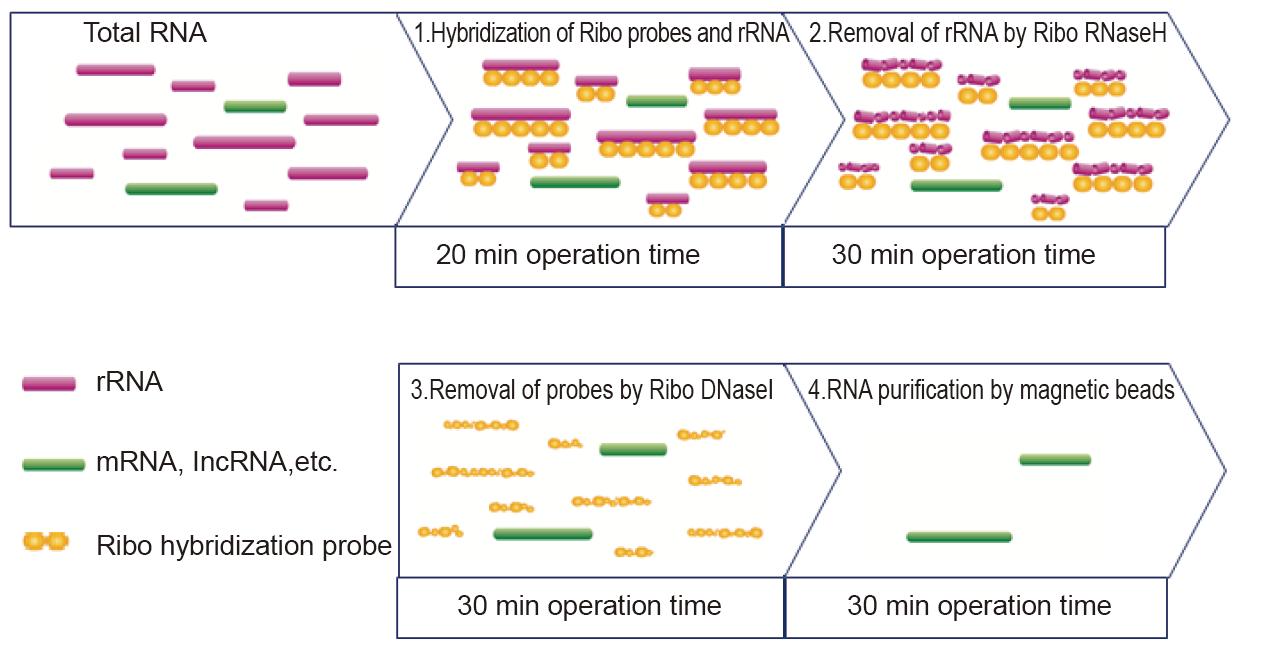
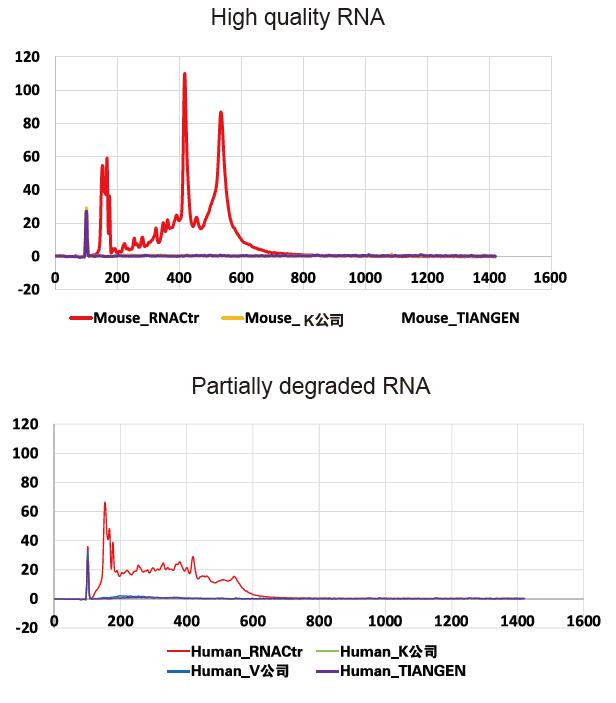 |
Agilent 2100の結果は、rRNAの除去が高品質(無傷)で部分的に分解されたサンプルに対して完了していることを示しています。 |
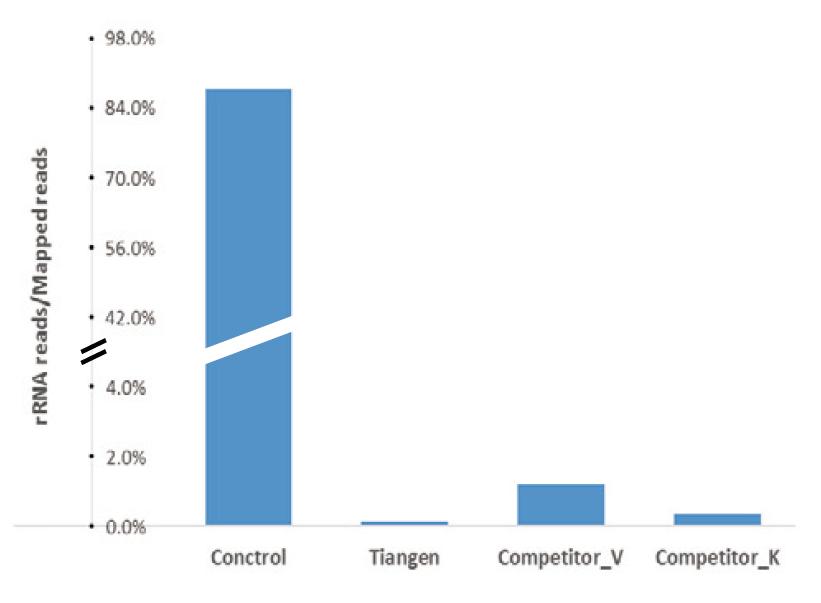 |
NGSシーケンシングの結果はrRNAが完全に除去されたことを示しました:マウス肝臓のトータルRNAのシーケンシング結果は、キットを使用してrRNAを除去する前に、コントロールグループのリードがマップされたリード全体の85%以上を占めていたのに対し、 TIANSeq rRNA Depletion Kit(H / M / R)除去後のrRNAは0.2%未満でした。マウス肝臓のトータルRNAのシーケンス結果は、キットを使用してrRNAを除去する前に、コントロールグループの読み取りが85以上を占めたことを示しています。 TIANSeq rRNA Depletion Kit(H / M / R)除去後のrRNAの読み取りが0.2%未満であるのに対し、マップされた読み取り全体の%。 |
現在、ハイスループットシーケンシング技術は主に次世代シーケンシング技術に基づいています。次世代シーケンシングテクノロジーの読み取り長は限られているため、完全長のシーケンスを小さなフラグメントライブラリに分割してシーケンスする必要があります。さまざまなシーケンス実験のニーズに応じて、通常、シングルエンドシーケンスまたはダブルエンドシーケンスを選択します。現在、次世代シーケンシングライブラリーのDNAフラグメントは、一般に200〜800bpの範囲で分布しています。

a)DNAは品質が低く、阻害剤を含んでいます。酵素活性の阻害を避けるために、高品質のDNAサンプルを使用してください。
b)PCRフリー法を使用してDNAライブラリーを構築する場合、DNAサンプルの量が不十分です。断片化されたDNAの入力が50ngを超える場合、ライブラリー構築プロセス中にPCRフリーのワークフローを選択的に実行できます。ライブラリーのコピー数が少なすぎて直接シーケンスできない場合は、アダプターライゲーション後にPCRでDNAライブラリーを増幅できます。
c)RNAコンタミネーションは不正確な初期DNA定量化につながるRNAコンタミネーションはゲノムDNAの精製プロセスに存在する可能性があり、ライブラリー構築中の不正確なDNA定量化と不十分なDNAローディングにつながる可能性があります。RNAはRNaseで処理することで除去できます。
A-1
a)小さなフラグメント(60 bp-120 bp)が表示される小さなフラグメントは通常、アダプターフラグメントまたはアダプターによって形成される二量体です。Agencourt AMPure XP磁気ビーズで精製すると、これらのアダプターフラグメントを効果的に除去し、シーケンス品質を確保できます。
b)PCR増幅後に大きなフラグメントがライブラリーに現れるライブラリーのDNAフラグメントのサイズは、アダプターがライゲーションされた後、120bp増加します。アダプターライゲーション後にDNAフラグメントが120bpを超えて増加する場合は、過剰なPCR増幅の異常なフラグメント増幅が原因である可能性があります。PCRサイクルの数を減らすと、この状況を防ぐことができます。
c)アダプターライゲーション後のライブラリーDNAフラグメントの異常なサイズこのキットのアダプターの長さは60bpです。フラグメントの両端をアダプターにライゲーションすると、長さは120bpだけ増加します。このキットで提供されているもの以外のアダプターを使用する場合は、アダプターの長さなどの関連情報をサプライヤーに問い合わせてください。実験のワークフローと操作がマニュアルに記載されている手順に従っていることを確認してください。
d)アダプターライゲーション前の異常なDNAフラグメントサイズこの問題の理由は、DNAフラグメント化中の誤った反応条件が原因である可能性があります。DNA入力ごとに異なる反応時間を使用する必要があります。DNA入力が10ngを超える場合は、最適化の開始時間として12分の反応時間を選択することをお勧めします。この時点で生成されるフラグメントサイズは、主に300〜500bpの範囲です。ユーザーは、必要なサイズでDNAフラグメントを最適化するために、独自の要件に応じて2〜4分間DNAフラグメントの長さを増減できます。
A-2
a)断片化時間が最適化されていない断片化されたDNAが小さすぎるか大きすぎる場合は、指示にある断片化時間選択のガイドラインを参照して反応時間を決定し、この時点をコントロールとして使用し、さらに設定します。断片化時間をより正確に調整するために3分を延長または短縮する反応システム。
A-3
断片化処理後のDNAの異常なサイズ分布
a)フラグメンテーション試薬の解凍方法が正しくない、または解凍後に試薬が完全に混合されていない。5×FragmentationEnzymeMix試薬を氷上で解凍します。解凍したら、チューブの底を軽くはじいて試薬を均一に混合します。試薬をボルテックスしないでください!
b)DNA入力サンプルにEDTAまたはその他の汚染物質が含まれているDNA精製ステップでの塩イオンとキレート剤の枯渇は、実験を成功させるために特に重要です。DNAが1×TEに溶解している場合は、説明書に記載されている方法で断片化を行ってください。溶液中のEDTA濃度が不確かな場合は、DNAを精製し、その後の反応のために脱イオン水に溶解することをお勧めします。
c)不正確な初期DNA定量化断片化されたDNAのサイズは、DNA入力の量と密接に関連しています。断片化処理の前に、Qubit、Picogreen、およびその他の方法を使用したDNAの正確な定量化は、反応システム内のDNAの正確な量を決定するために不可欠です。
d)反応システムの準備が指示に従わない断片化された反応システムの準備は、指示に厳密に従って氷上で実行する必要があります。最良の効果を確実にするために、すべての反応成分を氷上に置き、反応システムの準備は完全に冷却した後に実行する必要があります。準備が完了したら、フリックまたはピペットで完全に混合してください。ボルテックスしないでください!
1.不適切な混合方法(渦、激しい振動など)は、ライブラリフラグメントの異常な分布を引き起こし(次の図に示すように)、ライブラリの品質に影響を与えます。したがって、Fragmentation Mix反応溶液を調製するときは、ゆっくりと上下にピペッティングして混合するか、指先でフリックして均一に混合してください。渦と混ざらないように注意してください。

2.ライブラリーの構築には高純度のDNAを使用する必要があります
■良好なDNAの完全性:電気泳動バンドは30 kb以上で、テーリングはありません
■OD260 / 230:> 1.5
■OD260 / 280:1.7-1.9
3. DNA入力量は正確でなければなりませんNanodropではなく、QubitおよびPicoGreenメソッドを使用してDNAを定量化することをお勧めします。
4.DNA溶液中のEDTAの含有量を決定する必要がありますEDTAは断片化反応に大きな影響を及ぼします。EDTAの含有量が多い場合は、次のテストの前にDNA精製を行う必要があります。
5.フラグメンテーション反応溶液は、氷上で調製する必要があります。フラグメンテーションプロセスは、反応の温度と時間に敏感です(特にエンハンサーを追加した後)。反応時間の正確さを確保するために、氷上で反応システムを準備してください。
6.断片化反応時間は正確でなければなりません断片化ステップの反応時間は断片生成物のサイズに直接影響し、したがってライブラリー内のDNA断片のサイズ分布に影響します。
1.このキットにはどのような種類のサンプルが適用できますか?
このキットの該当するサンプルタイプは、トータルRNAまたはRNAの完全性が良好な精製mRNAです。全RNAを使用してライブラリーを構築する場合は、rRNA枯渇キット(Cat#4992363/4992364/4992391)を使用して最初にrRNAを除去することをお勧めします。
2. FFPEサンプルを使用して、このキットでライブラリを構築できますか?
FFPEサンプルのmRNAはある程度分解され、完全性は比較的低くなります。このキットをライブラリー構築に使用する場合は、断片化時間を最適化することをお勧めします(断片化時間を短縮するか、断片化を実行しないでください)。
3.製品マニュアルに記載されているサイズ選択手順を使用して、挿入されたセグメントがわずかにずれて見える原因は何ですか?
サイズの選択は、この製品マニュアルのサイズ選択手順に厳密に従って実行する必要があります。偏差がある場合は、磁気ビーズが室温にバランスしていないか、完全に混合されていないか、ピペットが正確でないか、液体がチップに残っていることが原因である可能性があります。実験には吸着の少ないチップを使用することをお勧めします。
4.ライブラリー構築におけるアダプターの選択
ライブラリー構築キットにはアダプター試薬が含まれていないため、このキットをTIANSeqシングルインデックスアダプター(イルミナ)(4992641/4992642/4992378)と一緒に使用することをお勧めします。
5.ライブラリのQC
ライブラリの定量的検出:QubitとqPCRを使用して、ライブラリの質量濃度とモル濃度をそれぞれ決定します。操作は製品マニュアルに厳密に従っています。ライブラリーの濃度は、通常、NGSシーケンスの要件を満たします。ライブラリの分布範囲の検出:Agilent 2100Bioanalyzerを使用してライブラリの分布範囲を検出します。
6.増幅サイクル数の選択
説明書によると、PCRサイクル数は6〜12であり、必要なPCRサイクル数はサンプル入力に応じて選択する必要があります。高収量のライブラリでは、通常、過剰増幅はさまざまな程度で発生します。これは、Agilent 2100 Bioanalyzerの検出でターゲット範囲のピークの後にわずかに大きいピークが現れるか、検出されたQubitの濃度がqPCRの濃度よりも低いことで示されます。軽度の過剰増幅は正常な現象であり、ライブラリーのシーケンスとその後のデータ分析には影響しません。
7.スパイクがAgilent2100Bioanalyzerの検出プロファイルに表示されます
Agilent 2100 Bioanalyzer検出でのスパイクの出現は、サンプルの不均一な断片化が原因であり、特定のサイズでより多くの断片が存在します。これは、PCR濃縮後に明らかになります。この場合、サイズの選択を行わないことをお勧めします。つまり、断片化条件を94°Cに設定して15分間インキュベートします。この場合、断片の分布は小さく、濃縮されており、均一性を向上させることができます。
製品カテゴリ
私たちを選ぶ理由
当工場は創業以来、原則を守りながら世界一流の製品を開発してきました。
最初に品質の。当社の製品は、業界で高い評価を得ており、新旧のお客様の間で貴重な信頼を得ています。








